抽样策略:目标1
该项目的这一部分涉及对基质进行表面取样,以回收可能存在的任何可存活的细菌和真菌分离物。 对于细菌和真菌分离物的培养,分别对胰蛋白酶大豆琼脂(TSA)和沙氏葡萄糖琼脂(SDA)进行取样。 将TSA平板在37℃温育24小时. 将SDA平板在30℃温育4-7天.18。 培养后,通过标准计数活微生物计算每个底物的相对污染率。 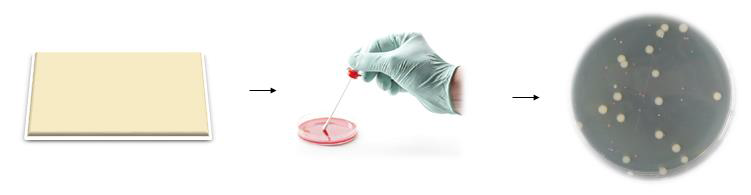
图1:来自底物的活细胞恢复程序的图示。
抽样策略:目标2
分别在LB肉汤和TSA肉汤中制备大肠杆菌,单核细胞增生李斯特氏菌和肠炎沙门氏菌的培养物。 将这些培养物在37℃温育过夜。 随后将培养物在评估的四个底物中的每一个上调节至所需的起始浓度。 通过擦拭方法接种基质,使用高(105 CFU / mL)数量的污染细胞。 在试验期间,发现可成功转移至每个底物的最高数量的污染细胞为~1-3×10 5 CFU / mL。 擦拭方法达到约105 CFU / mL的污染水平:将拭子浸泡在标准化至~1×10 7 CFU / ml的过夜培养物中。 然后使用浸泡的拭子分别转移每个底物的培养物。将底物干燥5分钟并再连续两次重复培养。在最后5分钟干燥后,将基材暴露于干冰清洗10秒。未进行干冰清洗的对照瓶与测试基质实验一起进行,并且在任何给定的测试日,每个上述概述的实验进行两次重复。 暴露后,将新鲜拭子浸泡在1 mL盐水溶液(Ringer's)中,然后用于从对照和Dry Ice Cleaned底物中回收存活的细胞。擦拭的表面区域如上所述用于细胞应用。每个基底用相同的拭子连续擦拭表面区域三次,以确保细胞的有效回收。然后将含有回收细胞的1mL体积的盐水溶液连续稀释并分别涂布在LB / TSA琼脂上,用于选择和计数。将平板在37℃温育过夜,并将存活的细胞表示为平均值±标准偏差。 通过测试和对照细胞活力计数之间的比较分析确定每个菌株/底物的去污策略的功效。 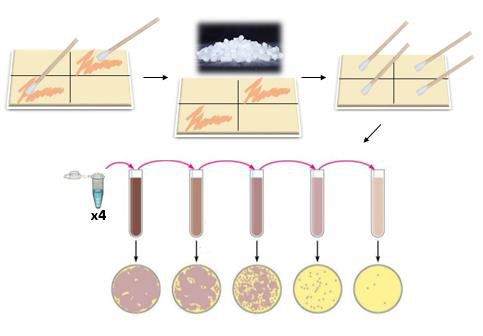
图2:干冰清洗挑战实验期间采样应用和从基板回收的图示。
对照代表用大肠杆菌接种但不用干冰清洗的瓷砖部分。 测试表示用大肠杆菌接种但用干冰清洁工艺清洁的瓷砖部分。 在干冰清洁基板的测试部分期间测试的用于大肠杆菌穿过基板表面的交叉转移的瓷砖部分。
研究第1部分的数据摘要: 研究一系列不同基质上存在的微生物负荷。 共筛选出7种不同的底物,以确定细菌和真菌的存在。 发现所有基质都含有非常低水平的污染微生物。 100%的基质含有文化细菌污染,42%的基质被发现被真菌污染。 总微生物计数范围为0-54菌落形成单位(cfu)/底物。 胰蛋白酶大豆琼脂(TSA)和沙氏葡萄糖琼脂(SDA)是分离一般微生物负荷的首选媒介。 
研究第2部分的摘要数据:
使用选择的革兰氏阳性和革兰氏阴性食品相关病原微生物研究干冰过程对人工污染基质的功效。 
摘要
从所获得的结果可以明显看出,干冰清洗过程是在暴露于规定的10秒暴露时从一系列不同基质中灭活革兰氏阳性和革兰氏阴性细菌的有效方法。 大肠杆菌,肠炎沙门氏菌和单核细胞增生李斯特菌的灭活率分别为98.73-100%,99.99-100%和99.62-100%。 此外,初步结果表明,在干冰清洗期间几乎没有微生物转移到清洁部分基质,在肠炎沙门氏菌试验期间转移明显为0.01%,对大肠杆菌和单核细胞增生李斯特菌的挑战有0.00%明显转移。实验。 此外,已经确定在这些基材上发现的天然污染水平通常较低。在研究的第2部分中用于人工污染基质的不同浓度的细菌远远超过环境中通常发现的水平,因此,突出了这种新型干冰清洁工艺作为新型去污装置的显着潜力。 选择革兰氏阳性菌和革兰氏阴性菌 - 最值得注意的是与食品工业密切相关的细菌。
致谢
TOOICE科技研究中心
|

